-
![[image]](https://www.balancer.ru/cache/sites/ru/nk/nkj/upload/iblock/9a9/128x128-crop/9a904df631297e43720515f5c60ed208.jpg)
Коронавирус - устройство, свойства, изменчивость
здесь - только сугубо биологические аспекты, даже без распространения и клиникиТеги:
Данное сообщение является официальным предупреждением
 Wyvern-2
#12.05.2020 14:00 @Bredonosec#12.05.2020 13:24
Wyvern-2
#12.05.2020 14:00 @Bredonosec#12.05.2020 13:24 - Wyvern-2 [12.05.2020 14:01]: Административное предупреждение: Wyvern-2#12.05.20 14:00
Zenitchik> Ау? Товарищи маршал с капитаном в курсе, что у коронавируса липидный капсид? Как мыло реагирует с липидами они в курсе?
Не ссорьтесь, горячие финские парни!
В данном вопросе кстати, прав скорее Костя. Обычное мыло (натриевые соли стеариновой и пальмитиновой кислот) липидные оболочки повреждает слабо. И слава богам за это, а то дерматитов было бы море. Более "сильное" мыло (СДС) дерматиты вызывает чаще (так как способно проникать под ороговевший слой ввиду большей растворимости в воде). Водорастворимые сильные эмульгаторы (типа плюроников, неонолов, синтанолов) дерматиты вызывают очень быстро, потому имеют исключительно техническое применение.
Так что разрушать вирусы мылом надо с осторожностью
Не ссорьтесь, горячие финские парни!

В данном вопросе кстати, прав скорее Костя. Обычное мыло (натриевые соли стеариновой и пальмитиновой кислот) липидные оболочки повреждает слабо. И слава богам за это, а то дерматитов было бы море. Более "сильное" мыло (СДС) дерматиты вызывает чаще (так как способно проникать под ороговевший слой ввиду большей растворимости в воде). Водорастворимые сильные эмульгаторы (типа плюроников, неонолов, синтанолов) дерматиты вызывают очень быстро, потому имеют исключительно техническое применение.
Так что разрушать вирусы мылом надо с осторожностью



Fakir> Жизнь и устройство коронавирусов | Наука и жизнь
Fakir> Собственно он:
научно достоверная 3D модель


Fakir> Собственно он:
научно достоверная 3D модель

Запись на стене
Коронавирус SARS-CoV-2: научно достоверная 3D модель В студии биомедицинской визуализации Visual Science создана наиболее детальная и научно достоверная трехмерная модель вируса SARS-CoV-2 в атомном разрешении. Модель основана на современных научных данных о строении коронавирусов, а также комментариях.. // vk.com
Коронавирус SARS-CoV-2: научно достоверная 3D модель
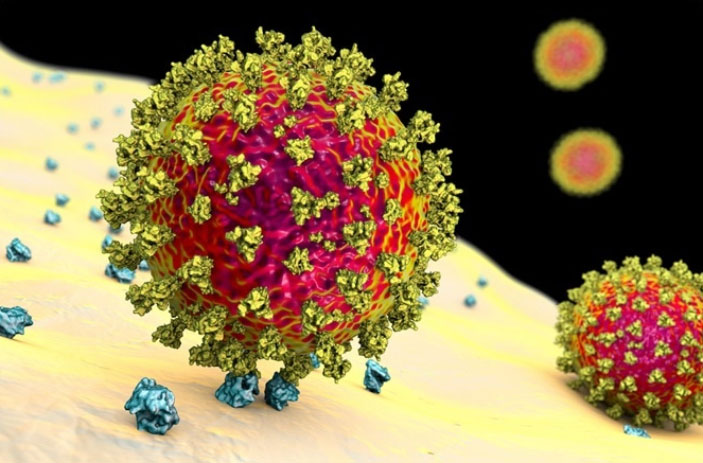
Научно достоверная 3D-модель коронавируса SARS-CoV-2 (возбудителя Covid-19) с подробным описанием структуры его вириона. // visual-science.com


Корона вируса • Картинка дня
На этом красочном рисунке изображена вирусная частица SARS-CoV-2. Розовые «шипы» — это S-белок, отвечающий за проникновение коронавируса в клетку и формирующий ту самую корону. В картинке дня подробно объясняем, как вирус проникает в клетку, заставляет ее производить копии своих белков и РНК и покидает клетку, чтобы заразить новые. // elementy.ruпространственная модель шипа (вид сбоку и сверху)
SARS-CoV-2, связавшийся с ACE2 (голубой) на поверхности клетки
Связывание вируса с ACE2 запускает в клетке процесс эндоцитоза: в месте контакта с вирусом клеточная мембрана вдавливается внутрь клетки, пока вокруг вируса не образуется пузырек. Внутри этого мембранного пузырька — эндосомы — вирус и попадает в клетку. Клетка использует эндоцитоз для поглощения крупных молекул, которые затем расщепляются и используются ею как сырье для синтеза нужных ей веществ. Поэтому в эндосомах есть свои «пищеварительные» ферменты — протеазы, которые разрезают белки, узнавая определенные последовательности аминокислот. На одной из внешних цепей S-белка как раз есть участок, который такие ферменты разрезают. Вирус только этого и ждет: под местом разреза обнажаются «пептиды слияния» (fusion peptides, см. Lipid bilayer fusion) — цепочки аминокислот, способные внедряться в мембрану эндосомы. Укороченный S-белок, одним концом связанный с мембраной вируса, а другим — с мембраной эндосомы, складывается, притягивая мембраны друг к другу. В результате мембрана вируса сливается с мембраной эндосомы, их целостность нарушается, и всё содержимое — включая геном вируса — выбрасывается наружу, в цитоплазму клетки.
из нескольких неструктурных белков собирается РНК-зависимая РНК-полимераза (РНК-репликаза) — белковый комплекс, способный синтезировать РНК по РНК (а не по ДНК, как это обычно происходит в клетке). Репликация РНК выполняется в два этапа, каждый из которых аналогичен транскрипции нитки ДНК в РНК. Сначала по принципу комплементарности на матрице геномной РНК синтезируется «антигеномная» РНК, которая уже служит матрицей для новых геномных РНК.
Вирусные РНК-полимеразы часто ошибаются и вставляют в РНК не те нуклеотиды — то есть вносят мутации. Это помогает РНК-содержащим вирусам быстро эволюционировать, однако из-за большой частоты мутаций они не могут позволить себе иметь длинный геном и много белков — всё время что-то будет ломаться. Поэтому средняя длина вирусных РНК-геномов — всего 9000 нуклеотидов. Но коронавирусы — исключение: длина их геномов достигает 30 000 нуклеотидов. Это связывают с тем, что у коронавирусов есть уникальный для РНК-вирусов белок, способный отрезать только что прикрепленный нуклеотид от синтезируемой цепи, если он не комплементарен матрице. Это помогает снизить процент ошибок при синтезе новых молекул РНК.
РНК-полимеразный комплекс коронавируса состоит из нескольких неструктурных белков (nsp, от англ. non-structural proteins). Nsp12 (собственно полимераза) — фермент, который осуществляет синтез РНК по матрице РНК. Nsp7 и nsp8 синтезируют для полимеразы «затравку» (primer), с которой начинается синтез новой цепи РНК. Nsp14 при содействии nsp10 контролирует, насколько аккуратно работает полимераза. Nsp9 держит матричную цепь в развернутом состоянии до прихода полимеразы.
Белки S, M и E — мембранные. Как и мембранные белки самой клетки, их синтезируют рибосомы, связанные с эндоплазматическим ретикулумом (ЭПР) — органеллой, представляющей собой совокупность мембранных полостей. С помощью специальных молекулярных комплексов белки внедряются в мембрану ЭПР прямо во время своего удлинения. Потом часть мембраны с новыми белками отпочковывается от ЭПР, получившийся транспортный пузырек отправляется к внешней клеточной мембране и впоследствии сливается с ней.
Вирусные белки, встроеные в мембрану пузырька, могут плавать по его поверхности и собираться вместе, так что из них складывается «мозаика». Молекулы белка М, связываясь друг с другом, образуют в стенке пузырька плотную решетку. Попутно, тоже связываясь с М, в решетку включаются копии белков E и S. Последние объединяются по трое и образуют шипы, смотрящие внутрь пузырька. Пока транспортный пузырек движется через клетку, с обращенными в цитоплазму участками белков М связываются многочисленные копии белка N, окружающие геномную РНК вируса. Все эти взаимодействия приводят к тому, что решетка смыкается вокруг вирусной РНК, и готовая вирусная частица — со свеженькой короной вокруг нее — оказывается внутри транспортного пузырька. А когда пузырек сливается с мембраной клетки, вирус оказывается снаружи.
Вылезают из клетки
Историко-филологический комментарий. Часто пишут:
И именно благодаря шипам-пепломерам, образующим вокруг вирусной частицы ореол, под микроскопом напоминающий солнечную корону, коронавирусы получили свое название. (Впрочем, сам шип, образованный тремя S-белками, тоже похож на корону, только обычную, а не солечную. Но выяснилось это, конечно, позже.)
Хотя согласно книжкам 80-х, коронавирусы получили своё название по причине иного сходства:
Из оболочки вирусных частиц диаметром 80—160 нм выступают большие, хорошо различимые гликопротеиновые выступы в виде булав — пепломеры. Свое название коронавирусы получили благодаря сходству этих выростов с corona spinarum — терновым венцом вокруг головы святого на средневековых религиозных картинах (Z. Almeida, личное сообщение). Некоторым авторам протяженные, радиально расположенные выступы напоминают солнечную корону.


О тестировании и его достоверности.


Проверка на вирус • Библиотека
Пара герметичных пластиковых пробирок с реагентами, пробирки с контрольными образцами плюс инструкция: тест-системы для определения вирусной инфекции — предметы совсем не зрелищные и не фотогеничные. Тем не менее в разгар пандемии именно от них зависит быстрая диагностика новой болезни, а часто и сама жизнь. // elementy.ruИменно поэтому официальные данные по количеству заболевших COVID-19, обнародованные КНР 12 февраля 2020 года, так огорошили мировую общественность. Обратив внимание на подозрительное множество людей, живущих в эпицентре вспышки, но не обнаруживших болезни после тестирования, власти изменили протокол испытаний, и цифры заразившихся за сутки подскочили с примерно 800 до почти что 15 тыс. В самом деле, точность и скорость работы метода ОТ-ПЦР зависят не только от самих реакций «в пробирке», но и от каждого шага в цепочке, которая начинается с выявления подозрительного больного.
Главной целью SARS-CoV-2 выступают клетки легочных альвеол, однако забор образца производят из носа или горла, где вирусных частиц на порядки меньше. В пробу их может попасть недостаточно, кроме того, она может оказаться загрязнена или банально испортиться из-за несоблюдения условий хранения, транспортировки и выделения РНК. Процесс включает множество мелких шагов, и на каждом из них возможна задержка или ошибка, тем более что тесты и протоколы разрабатывались в большой спешке. По сообщениям тех же китайских медиков, используемые ими системы дают положительные результаты не более чем у половины заболевших.



COVID-19: гонка вооружений — Троицкий вариант — Наука
Содержательно, спасибо! Но зачем репликацию РНК называть транскрипцией (в преамбуле и вопросе корреспондента), и по-видимому в расшифровке этой фразы — «В 1980–1990-е годы обсуждалась идея наличия РНК-зависимой полимеразы у вируса гриппа, но к единому мнению тогда не пришли.» — явно выпало существенное про коррекцию, а что у гриппа РНК-репликаза известно весьма давно. Содержательно, спасибо! Но зачем репликацию РНК называть транскрипцией (в преамбуле и вопросе корреспондента), и по-видимому в расшифровке этой фразы — «В 1980–1990-е годы обсуждалась идея наличия РНК-зависимой полимеразы у вируса гриппа, но к единому мнению тогда не пришли.» — явно выпало существенное про коррекцию, а что у гриппа РНК-репликаза известно весьма давно. // Дальше — trv-science.ruВ 1980–1990-е годы обсуждалась идея наличия РНК-зависимой полимеразы у вируса гриппа, но к единому мнению тогда не пришли. В 2006 году у коронавируса человека, а потом и у коронавируса мышей открыли экзонуклеазу, способную выполнять корректирующую функцию. Механизм ее работы до сих пор до конца неясен: вытесняет ли она полимеразу, или та подвигается, но в итоге у белка появляется возможность удалить «нуклеотид с ошибкой». Очень вероятно, что у SARS-CoV-2 такая корректирующая экзонуклеаза тоже есть.
— Значит ли это, что SARS-CoV-2 мутирует медленнее и у нас не будет таких проблем с многочисленными штаммами, которые есть у человечества с гриппом?
— У вируса гриппа есть специальный механизм, который повышает генетическое разнообразие этих вирусов. Если в клетке хозяина оказались одновременно два разных штамма, то вирусы могут обменяться сегментами при сборке вирусных частиц, что приведет к появлению нового штамма. Этот механизм называется реассортацией. У SARS-CoV-2 реассортации нет или, по крайней мере, она происходит крайне редко. Учитывая это, а также наличие механизма коррекции, логично ожидать, что он будет менее изменчив.
Тем не менее уже доказано (данные секвенирования вирусных геномов доступны), что в Китае, Италии и в CША распространены немного разные штаммы коронавируса COVID-19. Скорее всего, был лишь один момент перехода от животных к человеку, а наблюдаемые штаммы — результат эволюционного процесса. Насколько накапливаемые мутации способствуют патогенезу, вопрос спорный. Как правило, эволюция вирусов идет от большей патогенности к меньшей. (Для успешного существования вирусу нужно заражать новых хозяев, а для этого требуется, чтобы предыдущие хотя бы дожили до момента заражения.)
для создания вакцины — то есть не лечения, а предупреждения болезни — механизмы появления мутаций неважны. Тут гораздо важнее знать разнообразие как самих вирусов, так и антител, которые на них реагируют.
Учитывая историю других четырех коронавирусов, которые «перепрыгивали» на людей, я бы ожидал, что SARS-CoV-2 достаточно быстро приспособится к человеку и снизит свою патогенность. Но когда именно это в точности произойдет — сейчас сказать невозможно.


Выявленный на оптовом рынке в Пекине коронавирус, вероятно, более заразный, чем тот, что был обнаружен на рынке морепродуктов в Ухане, заявил профессор института вирусологии медицинского отделения Уханьского университета Ян Чжаньцю.
"В процессе эволюции инфективность вируса может усиливаться, а может ослабевать. Но я считаю, что обнаруженный на рынке "Синьфади" коронавирус SARS-CoV-2 более заразный, чем тот, что был на рынке "Хуанань" в Ухане", — заявил Ян Чжаньцю в интервью газете "Хуаньцю шибао".
Крупнейший оптовый рынок "Синьфади" в районе Фэнтай в субботу был временно закрыт после того, как эпидемиологическое расследование выявило коронавирус на доске для разделки импортированного лосося. В районе Фэнтай был введен режим военного времени, уровень реагирования на ЧС в области общественного здравоохранения вновь был повышен до II.
Представители правительства Пекина сообщили, что в воскресенье в городе протестировали на коронавирус 76 499 человек, анализы 59 оказались положительными. При этом в утренней статистике в понедельник сообщалось, что в воскресенье в городе было выявлено 42 случая COVID-19, из них 36 — с клиническими проявлениями, в шести случаях болезнь протекала без симптомов. В общей сложности в настоящий момент в больницах города находятся 79 человек с COVID-19, один из них в критическом состоянии, двое — в тяжелом.


Биологи представили модели распространения COVID-19
ФИЦ ИВТ и компания «Биософт» представили результаты разработки компьютерного симулятора распространения инфекции на примере Новосибирской области. // infopro54.ruПроблема оценки влияния мутаций вируса на его распространение и воздействие на человека была поднята в разрезе анализа смертности от коронавируса. Директор Института программных систем имени А.К. Айламазяна Российской академии наук член-корреспондент РАН Сергей Абрамов обратил внимание на факт снижения смертности от коронавирусной инфекции COVID-19: в первое время смертность достигла и удерживалась на уровне 10%, в дальнейшем эта характеристика плавно снижалась, достигнув к началу июня значений 2-3%.
Возможность мутаций вируса, приводящих к снижению его негативного влияния на организм и летальности, названа в числе основных вероятных причин. Также отмечено, что важным фактором снижения смертности от COVID-19 является разработка и повышение эффективности протоколов лечения и, конечно, изменение статистических характеристик, в частности, вследствие повышения числа тестируемых, в том числе, массовое тестирование, включившее безсимптомных заболевших.
Специалисты подчеркивают, что изучение вопроса мутации SarS-CoV2 является важным направлением исследований биологов-вирусологов совместно с математическими биологами. Так, американские исследователи пришли к выводу, что самая распространенная мутация вируса D614G увеличивает эффективность его проникновения в клетку, преодоления им соответствующих клеточных барьеров и механизмов защиты, что приводит к повышению заразности в 2,5-8 раз (Страница не найдена - ТАСС. Модели распространения COVID-19 должны учитывать эти динамические характеристики.

Самая распространенная мутация повышает заразность коронавируса от 2,5 до 8 раз
Она встречается более чем у половины изученных штаммов SARS-CoV-2 // nauka.tass.ruАмериканские молекулярные биологи выяснили, что самая распространенная мутация в геноме SARS-CoV-2, характерная более чем для половины изученных штаммов вируса, улучшает его способность проникать в клетки от 2,5 до 8 раз.
"Широко распространенная мутация D614G значительно ускоряет передачу вируса между самыми разными типами человеческих клеток, включая клетки из легких, печени и кишечника. Одной из причин повышенной заразности вируса может быть то, что эта мутация делает SARS-CoV-2 более стойким к человеческим ферментам", – пишут исследователи.
С первых дней появления вспышки коронавирусной инфекции ученые пытаются понять, в какую сторону и как эволюционирует ее возбудитель SARS-CoV-2. Сегодня известно, что он накапливает мутации примерно с той же скоростью, как и возбудитель гриппа. Однако как эти мутации влияют на заразность и другие свойства вируса, ученые пока достоверно не знают.
В частности, еще в начале марта китайские биологи заявили, что вирус мог разделиться на два подтипа – S и L, которые отличаются друг от друга остротой симптомов и скоростью распространения. Другие ученые в этом усомнились, отметив, что изменения в общем генофонде вируса могли быть вызваны различными случайными процессами, а не реальными отличиями в заразности этих подтипов SARS-CoV-2. В мае ученые из Британии и Австралии показали, что в человеческой популяции циркулирует сразу три разновидности вируса.

У коронавируса нашли три подтипа. Они повысили его заразность
Причем если о первых двух подтипах специалисты ранее уже писали, то о третьем они узнали впервые // nauka.tass.ruМолекулярные биологи проанализировали геномы нескольких тысяч штаммов SARS-CoV-2 и пришли к выводу, что вирус разделился на три отдельных линии, у каждой из которых – свой набор мутаций в ключевых генах.
"Наши наблюдения показывают, что сейчас в мире параллельно циркулируют три разных линии SARS-CoV-2, которые значительно отличаются друг от друга с точки зрения эпидемиологии. К примеру, линия C, для которой характерна высокая скорость роста, появилась в Европе, в конце февраля. Характерные для нее мутации расположены в тех участках генома вируса, которые непосредственно отвечают за его размножение и проникновение в клетки"
Как оказалось, вирус можно разделить на три отдельных линии, которые отличаются как заразностью и прочими биологическими свойствами, так и тем, как именно они распространялись по разным уголкам Земли. Первые две из них, которые ученые назвали "линией A" и "линией B", по своим свойствам похожи на подтипы S и L, которые ранее предложили китайские ученые.
Исследователи отмечают, что они достаточно слабо отличаются друг от друга. Эти разновидности появились в первые дни развития эпидемии, еще в ноябре или в декабре 2019 года. Изначально "линия A" и "линия B" распространялись на территории Китая, однако впоследствии они попали в другие страны Азии и на западное побережье США.
Третий подтип коронавируса, "линия C", появился значительно позже, в конце февраля. Он возник на территории Европы и отличается от двух других набором значимых мутаций в гене S, которые отвечает за проникновение SARS-CoV-2 в клетки человека, и в гене ORF1ab, критически важном для размножения вируса.
Эти изменения, как отмечают исследователи, не только повысили заразность вируса, но и сделали его более изменчивым, ускорив процесс накопления мутаций в его геноме. Появление "линии C", как предполагают Чарльстон и его коллеги, объясняет то, почему вирус начал стремительно распространяться по Европе в начале марта. Сейчас эта линия – самая распространенная разновидность вируса в мире.
При этом исследователи не исключают, что "линия C" могла так быстро распространиться по Европе и из-за случайных факторов, – к примеру, из-за того, что она первой проникла на ее территорию и смогла закрепиться там. Как отмечают исследователи, последующие наблюдения за их распространением, особенно в странах Ближнего Востока, по которым почти нет данных, покажут, какая из этих двух гипотез ближе к истине.


- ED [28.10.2020 14:54]: Перенос сообщений из Треп за вакцины...
- Fakir [28.10.2020 16:26]: Перенос сообщений в Вирусы и противовирусные средства, изменчивость вирусов
- Fakir [06.12.2020 00:53]: Перенос сообщений в Воздействие коронавируса на организм

«Коронавирус научился быстрее распространяться»
Мировая звезда вирусологии Евгений Кунин — об особенностях генома SARS-CoV-2, эффективности вакцин и мутациях патогена // iz.ruSARS-CoV-2 — очень сложный вирус среди РНК-содержащих. И похоже, что у него есть специальные гены, которые влияют на иммунитет хозяина, подавляя его. И, если это так, вероятно, вакцина может работать лучше, чем иммунитет у переболевших. Так как в вакцине представлены или фрагменты вируса, или использован его инактивированный (убитый) вариант. То есть препарат вызывает реакцию иммунитета, но при этом не подавляет его.
— У SARS-CoV-2 есть какие-то дополнительные гены?
— Да. Их же имеет первый SARS (вызвавший вспышку атипичной пневмонии в 2002–2003 годах) и MERS (вспышка ближневосточного респираторного синдрома в 2012–2013 годах). Именно эти гены, по-видимому, влияют на иммунитет. Мы их также находим в ближайших родственниках таких же коронавирусов у летучих мышей.
— Где располагаются эти гены?
— В конце генома. А вот за что они отвечают — непростой вопрос. Мы сделали любопытное наблюдение: длительность инкубационного периода заболеваний, вызываемых разными эрэнковыми вирусами, коррелирует со сложностью их генома. То есть более сложные вирусы, у которых больше генов, вызывают при заражении более длинный инкубационный период.
— SARS-CoV-2 сильно мутирует?
— По меркам эрэнковых вирусов он мутирует очень медленно. Это нужно понимать правильно. Все эрэнковые вирусы мутируют быстро, но среди них вот этот — медленнее всего.
— Сколько геномов коронавируса вы изучили?
— Мы видели 200 тыс. геномов SARS-CoV-2, из них в хорошем качестве примерно 40 тыс. Сравнивая их, мы пытались проследить эволюцию. Сейчас понятно, что вирус несомненно адаптируется: приспосабливается к тому, чтобы лучше распространяться в популяции хозяина. Наблюдается сложная динамика циркулирования его штаммов в разных частях мира, тут есть тенденции как к глобализации, так и к местной диверсификации. И эти тенденции борются друг с другом.
— Как он меняется?
— Коронавирус научился быстрее распространяться.
— А тяжесть протекания COVID-19 и смертность увеличиваются?
— Нет.
— Можно ли сказать, что во вторую волну больше зараженных, поскольку вирус адаптировался?
— Это слишком смелое заявление. Действительно, сейчас заболевших больше, а смертность стала меньше. Но здесь накладывается слишком много факторов. Это и человеческое поведение, и погода, которая в некоторых случаях все-таки снижает иммунитет, и стратегия тестирования. Глядя на ежедневный прирост количества зараженных, мы не всегда понимаем, что означает это число. Можно сказать так: рост числа зараженных обусловливается многими факторами, и мутации вируса — один из них, но не главный.
— Есть две противоположные гипотезы возникновения коронавируса. Одни эксперты говорят, что он проник в человеческую популяцию из природы. Другие считают, что патоген могли доработать. Сторонники последней идеи обращают внимание на фуриновую вставку — это небольшой фрагмент генома, которая кажется им подозрительной. Что вы о ней думаете?
— Она действительно выглядит подозрительной. Причем в очень определенном смысле. Она почти наверняка не происходит из генома данного вируса. Такая вставка может возникнуть двумя путями. Либо путем дупликации из этого же генома, когда полимераза ошибается и удваивается определенный кусочек последовательности. Либо путем рекомбинации — это процесс перегруппировки генетического материала, в результате которого появляются новые сочетания генетических структур. И источник для рекомбинации может быть разным. Что ясно про эту вставку: она не возникла ни путем дупликации, ни путем рекомбинации с геномами того же вируса. Там совсем другой нуклеотидный состав. Хотя вставка и короткая, в геноме коронавирусов таких последовательностей нет. Таким образом, единственный путь ее возникновения — рекомбинация с какими-то клеточными генами. Прямо сейчас мы исследуем этот вопрос и через некоторое время выпустим статью на эту тему.
— Какие есть кандидаты на звание источника для рекомбинации?
— Такие кандидаты есть в том числе в генах летучих мышей. Но с уверенностью тут сделать выводы, наверное, не удастся никогда, так как эта вставочка очень коротенькая: всего 12 нуклеотидов.
— Могли ли эту вставку внести вручную? Ведь технологии адаптации вирусов к человеческим клеткам и повышение патогенности вирусов уже разработаны. А одна из них была описана в знаменитой статье 2015 года в журнале Nature.
— Мы тут уходим в область конспирологии, а туда я не хожу. Давайте так: законов природы, которые запрещали бы такое сделать, нет. Но в принципе все лаборатории такого уровня, как Уханьская, соблюдают протоколы. Тут опираться можно только на презумпцию невиновности. И если какое-то расследование обнаружит следы, мы будем рассматривать эти варианты. Никто не отрицает, что вирус можно в лаборатории адаптировать к человеческим клеткам. И в 2015 году была сделана хорошая научная работа. Но у нас нет никаких данных о том, что SARS-CoV-2 является результатом таких экспериментов.



Очная вставка: откуда в SARS-CoV-2 фрагмент человеческого гена
Новый коронавирус мог перейти межвидовой барьер еще в 2012 году // iz.ruОпираясь на факты магистерской диссертации, Лэтэм и Эллисон делают выводы: «Во-первых, мы предполагаем, что в организме шахтеров RaTG13 (самый генетический близкий к новому коронавирусу образец, найденный к настоящему времени) или очень похожий вирус превратился в SARS-CoV-2 — необычно патогенный коронавирус, высоко адаптированный для человека. Во-вторых, лаборатория Ши использовала медицинские образцы, взятые у шахтеров. Именно этот адаптированный к человеку вирус, теперь известный как SARS-CoV-2, сбежал из Уханьской лаборатории в 2019 году».
Согласно исследованию Лэтэма и Эллисона получается, что нулевой пациент, стоявший в начале нынешней пандемии, уже унесшей жизни около 650 тыс. человек, появился еще в 2012 году. Именно легкие шахтеров создали уникальные возможности для рекомбинации в РНК вируса. Там, в геноме вируса, благодаря вставке из 12 нуклеотидов, и возник тот самый фуриновый сайт из восьми аминокислот, необходимый патогену для проникновения внутрь клетки человека. Полностью соответствующий такому же фрагменту человеческого белка и его гена.
— Эти шахтеры действительно попали в уникальную ситуацию, так как подверглись очень большой вирусной нагрузке, — считает профессор кафедры геномики и биоинформатики СФУ, профессор Гёттингенского университета (Германия) Константин Крутовский. — Ведь они не просто работали в шахте, их задачей было очистить ее от накопившихся в огромном количестве экскрементов летучих мышей, которые как известно, особенно насыщены коронавирусами. Вполне вероятно, что у одного из шахтеров могла произойти рекомбинация РНК коронавируса с РНК гена человека (контролирующего белок ENaC-ɑ) и имеющего такую же фуриновую вставку. Считается, что именно благодаря ей значительно возросла эффективность проникновения SARS-CoV-2 внутрь клеток. Не исключено также, что рекомбинация произошла между SARS-CoV-подобными вирусами, один из которых уже имеет эту вставку. Однако он пока не обнаружен в природе.
Лэтэм и Эллисон приводят математические расчеты. Они указывают на то, что стандартные коронавирусные инфекции ограничены горлом и верхними дыхательными путями. SARS-CoV-2 же развивается как раз в легких. Легкие намного больше как по весу, так и по площади поверхности, нежели верхние дыхательные пути. Таким образом, пишут они, «количество потенциально зараженной ткани в среднем легком примерно в 4,5 тыс. раз больше, чем доступно для обычной коронавирусной инфекции».
Впрочем, опрошенные «Известиями» эксперты не исключают и абсолютно случайной возможности приобретения вирусом этой фуриновой вставки, которая может быть никак не связана с человеческим геномом.
— Когда речь идет о совпадении в таком коротком фрагменте, нет ничего удивительного, что при анализе большого генома (такого, как геном человека) найдутся точные совпадения, — уверен старший научный сотрудник Института проблем передачи информации имени А. А. Харкевича РАН, биолог Александр Панчин. — Конспирологи на основании фрагментарного сходства уже делали выводы, что SARS-CoV-2 создан благодаря вставкам ВИЧ, что он сделан с использованием вставок человека. С тем же успехом можно сказать, что он сделан с вставками из ламантинов, рачков или грибов. Или что ламантины созданы с вставками из человека.
Тем не менее вполне обоснованной остается и гипотеза, согласно которой штамм, попавший в лабораторию Ши Чженли от шахтеров, подвергался направленной эволюции. То есть вероятность того, что вставка была сделана вручную, тоже существует.
По словам Сергея Нетесова, принципиальная возможность замаскировать под природный искусственно созданный штамм имеется.
— Это стало возможным, когда всемирно известная компания Thermo Fischer усовершенствовала свой набор для генной инженерии, который позволяет делать вставки в большие геномы практически в любом месте, и при этом место вставки не маркируется никакими специфическими сайтами, — отметил он в разговоре с «Известиями».
Профессор подтвердил, что гипотеза, согласно которой такой имитирующий природную эволюцию штамм могли получить путем комбинации генно-инженерных и последующих селекционно-пассажных методов, а потом случилась утечка из лаборатории, в результате чего штамм попал в человеческую популяцию и вызвал нынешнюю эпидемию, имеет право на существование.



Коронавирус научился обходить антитела
Ученые обнаружили первую мутацию коронавируса, способную распознавать антитела и противостоять им. Об этом в субботу, 5 декабря, сообщает «РИА Новости» со ссылкой на журнал Nature. // iz.ruУченые обнаружили первую мутацию коронавируса, способную распознавать антитела и противостоять им. Об этом в субботу, 5 декабря, сообщает «РИА Новости» со ссылкой на журнал Nature.
Американские исследователи из Онкологического центра Фреда Хатчинсона нашли одну мутацию SARS-CoV-2, которая маскирует его от всех антител, выработанных для борьбы с вирусом. Кроме того, были найдены мутации, которые ускользали выборочно от одного из трех антител.
Отмечается, что одна мутация была обнаружена у заболевших по всей Европе. Другая локально распространяется в Нидерландах и Дании — образцы вируса с таким изменением были взяты у норок и людей, работающих на норковых фермах в этих странах.



Новый штамм коронавируса: что мы о нем знаем? - BBC News Русская служба
Быстрое распространение нового штамма коронавируса вызвало введение жесткого локдауна в Лондоне и на юго-востоке Англии, отменило рождественские послабления для жителей Англии, Шотландии и Уэльса и заставило ряд стран ввести запрет на авиасообщение с Британией. // www.bbc.com


«Нужна агрессивная вакцинация против коронавируса по всему миру» — Троицкий вариант — Наука
Работаю в небольшой компании в Москве, на работе регулярно около 10 человек. 5 уже переболели. Да, 1 тяжело, лежал в больнице. Остальные обошлись без докторов. Причем ПЦР тест полная ерунда, у многих отрицательный, т.к. на ватной палочке не набирается никакого материала. Я после болезни не поленился сдать кровь на антитела (>300 G/ml), там хотя-бы шприц набирают. И зачем эти вакцины нужны, если половина так или иначе уже переболела? Повторные заражения единичны, а эффективность вакцин // trv-science.ru— Как, на ваш взгляд, эволюционирует этот вирус?
— Вирус эволюционирует, как ему и положено, стараясь увеличить свою заразность — больше его ничто не интересует. Поскольку было бы странно, если бы свалившийся на нас из летучей мыши вирус был идеально приспособлен для распространения среди людей, неудивительно, что эта эволюция успешна. Насколько далеко она зайдет — никто не знает. Пока что заразность увеличилась (у британского варианта) раза в полтора, что плохо, но не максимально плохо.
С появлением большой доли людей с иммунитетом — естественным или в результате вакцинации — вирус, кроме того, будет эволюционировать так, чтобы созданного старыми генотипами (и вакцинами против них) иммунитета не бояться — как это делает грипп. Насколько это у него будет получаться — неизвестно, но надо ему всячески препятствовать: строго изолировать больных с хроническим течением ковида и быстро всех прививать, раз уж начали.
А вот как будет эволюционировать вирулентность вируса, неизвестно. Что он обязан стать белым и пушистым «сезонным ОРВИ» — распространенное заблуждение. Может быть и так, и так в зависимости от того, что помогает вирусу распространяться — бо́льшая вирулентность или меньшая. Поскольку больные заразны в основном на ранних стадиях болезни и значительная доля заражений происходит через бессимптомных носителей, разумно предположить, что вирус может позволить себе бо́льшую вирулентность. Какая ему разница, что больной умрет через три недели после того, как он перестал быть заразным, — главное, чтобы он побольше вируса выделял в первые дни после заражения. Коронавирусы умеют убивать: летальность MERS порядка 30%.
Худший вариант — возникновение многих вирулентных вариантов ковида без перекрестного иммунитета. К сожалению, этого исключить нельзя, и единственный способ уменьшить вероятность такого развития событий — агрессивная вакцинация по всему миру; если понадобится, против многих штаммов. Не думаю, что человечеству понравится сосуществовать с новым эволюционирующим коронавирусом — надо всеми силами стараться его полностью искоренить. Поскольку, в отличие от гриппа, его передача к нам от других животных очень редка, эта задача не безнадежна.
— Что вам самому кажется сейчас самым важным в борьбе с этим вирусом?
— Максимальная агрессивность. Искоренять вирус надо здесь и сейчас: чем больше разнообразных его генотипов успеет возникнуть, тем труднее будет этого добиться.
И очень похоже, что коронавирус не настолько быстро эволюционирует, как вирус гриппа: и скорость мутаций меньше, и рекомбинации (почти?) нет, и нет подпитки новыми вариантами от других видов-хозяев. Так что, если всех оперативно и настойчиво прививать, вирусу конец. А вот будет ли это сделано, не знаю.
Даже в развитых странах это непросто — и из-за бардака, и потому, что молодым вирус угрожает мало, так что им прививаться — это дело социальной ответственности, а не шкурного интереса. А если привить только пожилых, то смертность резко снизится, но при этом возникнут идеальные условия для эволюции новых устойчивых генотипов вируса. А ведь есть еще Нигерия и Пакистан, каковых вполне хватит, чтобы снабжать новыми генотипами весь мир, если их бросить на произвол судьбы.



Этот вирус мы победим. Вопрос лишь в цене победы — Троицкий вариант — Наука
Интервью понравилось, — всегда интересно наблюдать работу талантливых профессионалов, разделенных барьером вопросов-ответов. Похоже, Евгению Кунину удаются научные предсказания – на изумительный вопрос о шансах человечества в борьбе с вирусом он дал воодушевляющий прогноз, — в его правильности человечество убеждается каждое мгновение. Я тоже считаю его абсолютно достоверным – даже если человечество не будет носить маски и вакцинироваться. Мне импонирует его геохимическая активность, неравнодушие к ситуации с правами человека. // Дальше — trv-science.ruДавайте я начну не с продвижений, а с понимания эволюции вируса.
Здесь есть важный сдвиг. Появление новых высокоинфекционных вариантов ясно показывает, что вирус COVID-19 адаптируется. Дебаты по этому поводу более неуместны. Справедливости ради замечу, что мы сделали такой вывод уже какое-то время назад, вот здесь [1].
Но как-то многие в это не верили. Теперь — верят. И еще: теперь ясно, что вирус вовсе не обязательно эволюционирует в сторону снижения вирулентности. И это, конечно, было ясно раньше, ну вот хоть здесь [2]. Но опять-таки, с появлением новых вирулентных вариантов дебаты более неуместны.
Всё это, в общем, плохие новости. Вполне предсказуемые и предсказанные. Понимать это важно, в частности, и для того, чтобы осознавать важность ограничения распространения вируса (ношения масок и пр.). Снижение размера популяции вируса уменьшает вероятность возникновения новых вариантов: элементарная популяционная генетика. А продвижение по борьбе только одно — вакцины.
— Что вам самому кажется сейчас самым важным в борьбе с этим вирусом?
— Разумеется, достаточно быстрая и полная вакцинация населения.
— Увенчается ли эта гонка вооружений (эволюция вируса vs разработки науки) успехом человечества?
— Конечно, я в этом убежден. Вопрос в цене победы, во всех смыслах — и прямых потерь, и времени, и экономических последствий. А это трудно пока предсказать. Многое зависит от того, появятся ли высокоинфекционные варианты, устойчивые к вакцинам.



О двух вариантах белка S в мРНК и аденовирусных векторных вакцинах против COVID-19
Тема вариантов белка S в вакцинах против COVID-19 всплыла в обсуждениях печально известных «тромбзов/тромбоцитопений» после прививки вакцинами AstraZenaca и JJ. Об этих вариантах я уже писал ( Вакцины против COVID: S антиген есть у всех, но не все S антигены «равны»: prof_afv — ЖЖ ), но было это довольно давно и тот пост, наверное, не… // prof-afv.livejournal.comТема вариантов белка S в вакцинах против COVID-19 всплыла в обсуждениях печально известных «тромбзов/тромбоцитопений» после прививки вакцинами AstraZenaca и J&J. Об этих вариантах я уже писал (https://prof-afv.livejournal.com/34934.html), но было это довольно давно и тот пост, наверное, не все читали. Поэтому я решил повторить соответствующий фрагмент старого поста, с небольшим осовремениванием.
Все высокотехнологичные вакцины против COVID-19, независимо от платформы, «заточены» на доставку одного и того же белка SARS-CoV-2. Это белок SPIKE (он же белок S или гликопротеин S). На первый взгляд может показаться, что лучше всего «сформулировать» вакцину так, чтобы 3-D конфигурация белка S в ней точно соответствовала бы природной. Но «конструируя» вирус эволюция отнюдь не имела целью сделать его максимально уязвимым для иммунных ответов. Наоборот, целью (это фигура речи, не более) было сделать вирус максимально жизнеспособным. И природа нашла элегантное решение – конфигурация белка S не статична, она меняется после связывания этого белка с рецептором ACE2. В ходе этой трансформации белок S меняет свою форму и разрезается в определённых местах протеазами. В результате создаются подходящие условия для слияния (fusion) вирусной оболочки и клеточной мембраны, что приводит к проникновению вируса в клетку. Плюс вирус «ускользает» от иммунных ответов.
А у разработчиков вакцин цель противоположна – убить вирус иммунным ответом. Для этого нужно «навязать» свою игру – так модифицировать белок S, чтобы он был «заточен» не на эффективное проникновение внутрь клетки, а на то, чтобы максимально вызвать «огонь на себя» - то есть вызвать мощные иммунные ответы. Но как это сделать? Результаты фундаментальных исследований и испытаний на обезьянах показали, что наиболее иммуногенным белок S является тогда, когда он «зафиксирован» в конфигурации ДО связывания с рецептором (stabilized pre-fusion configuration). Оказалось, что для этого необходимы две аминокислотные замены в S2 части этого белка. В строго определённых местах (позиции 986 и 987) стоящие там аминокислоты должны быть заменены на пролин. Такой адаптированный для вакцин вариант белка S c двумя заменами на пролин (S2P) использован в вакцинах Pfizer-BioNTech, Moderna и J&J, а в вакцине AstraZeneca этих замен нет. Таким образом, предположение о том, что модификация белка S может быть одной из причин развития тромбзов/тромбоцитопений противоречит фактам: это осложнения не наблюдается у привитых вакцинами Pfizer-BioNTech и Moderna (обе SP2+), но наблюдается у привитых вакциной AstraZenrca (SP2-) и J&J (SP2+). Иными словами, связи между присутствием в вакцине того или иного варианта белка S и риском этого осложнения нет.


Супотницкий.

Мнение о происхождении сомнительное, но.

Военный микробиолог раскрыл тайны развития СOVID-19: «Пандемия будет затухать и разгораться»
Люди устали бояться, измучились болеть, умирать, хоронить, прятаться, ходить в масках, читать про коронавирус, смотреть про коронавирус, считать волны и давать им названия — первая, вторая... Но что же делать? О третьей волне COVID-19, а также о том, почему коронавирус был неизбежен, откуда он мог появиться и что его родиной мог быть совсем не Китай, мы поговорили с известным российским микробиологом Михаилом СУПОТНИЦКИМ, полковником медицинской службы запаса, автором исследований по истории эпидемий чумы и других особо опасных инфекций, исторических исследований о разработках и применения химического и биологического оружия. // www.mk.ruВ Индии в прошлом году все было относительно стабильно. Так казалось их властям. А тем временем туда стекались варианты вируса из Европы, Африки, США, Пакистана, Непала... В октябре прошлого года в отобранных образцах был обнаружен вариант B.1.617, имевший 13 мутаций, менявших его свойства в сторону большей заразности с одновременным ускользанием от специфических антител, другая мутация позволяла ему обойти некоторые иммунные реакции организма. Это стало результатом искусственного отбора (в понимании Чарльза Дарвина, результатом так называемого селективного давления, оказанного на популяции вирусов человеком), но что именно оказало такое воздействие, сейчас трудно сказать. Индийский вариант SARS-CoV-2 составил 70,4% образцов, собранных в течение недели, закончившейся 25 марта, по сравнению с 16,1% тремя неделями ранее.
Мнение о происхождении сомнительное, но.
– Первое – наличие неизвестных природных очагов. Я предполагаю, что пандемия началась с регионов, где есть природные очаги SARS-CoV-2. Генетический материал SARS-CoV-2 обнаружен в образцах сточных вод испанского города Барселоны, отобранных в марте 2019 года. Это обстоятельство противоречит первоначальным оценкам, относящим появление этого вируса в Южной Европе на конец января 2020-го. В Италии та же ситуация, генетический материал SARS-CoV-2 в сточных водах Милана (Ломбардия) и Турина (Пьемонт) обнаружен в образцах, отобранных в декабре 2019-го. Первые два случая COVID-19 у китайских туристов в Италии диагностированы 31 января 2020 года в Риме. То есть к моменту их приезда в Италию SARS-CoV-2 там уже циркулировал. Заболевшие сразу были помещены в изолятор в Риме. На фоне появившейся у итальянцев эпидемической настороженности, 20 февраля (т.е. через два инкубационных периода болезни) в Кодоньо (а это уже Ломбардия, от Рима полтыщи километров по автодороге), был обнаружен первый случай заражения итальянца SARS-CoV-2.
С китайскими туристами он контактов не имел. И если бы не то что произошло ранее, скорее всего, ему поставили диагноз «внебольничная пневмония».
Второе – ройный характер движения SARS-CoV-2 по популяциям людей и расходящаяся эволюция штаммов вируса в ходе пандемического процесса с временным преобладанием доминирующего штамма.
– Получается, что Китай здесь ни при чем? Вирус появился где-то ещё? Как он попал в европейскую канализацию?
– Сам факт обнаружения РНК SARS-CoV-2 в 2019 году в сточных водах Барселоны, Милана и Турина не говорит о том, что вирусы появились там на момент отбора проб, а не были еще раньше, причем намного раньше. Ясно, что это не завоз, и ноябрьская вспышка COVID-19 в Ухань была только одной из многих в 2019 году. SARS-CoV-2 распространялся среди европейского населения единичными случаями и локальными вспышками COVID-19, но принимался врачами за грипп или тяжелую «внебольничную пневмонию». В Италии, особенно в ее северной части и в Сардинии, несколько лет назад были обнаружены инфицированные SARS-подобными коронавирусами летучие мыши. То есть в этих регионах давно существуют экосистемы, вмещающие SARS-подобные вирусы. Там и нужно искать SARS-CoV-2. Думаю, не случайно в марте-апреле 2020 года именно на севере Италии пандемия COVID-19 достигла катастрофических размеров, тогда как в центральной Италии и на юге страны эпидемии практически не было.
– Но от чего зависит эволюция штаммов вируса? И какой именно штамм в ходе пандемического процесса может стать доминирующим?
– Во время первой и частично второй пандемической волны, то есть до развертывания программ массовой вакцинации и применения плазмы выздоровевших, популяционный отбор вариантов SARS-CoV-2 не управлялся специфическими антителами хозяина, то есть ничем не сдерживался, потому что не существовало достаточного количества индивидуумов, переболевших и сформировавших специфические к вирусу антитела. Далее селективные преимущества получали варианты с одной или несколькими мутациями в S-белке, которые увеличивали передаваемость вируса. А сегодня на фоне массовой вакцинации и применения плазмы переболевших вирус отбирает доминирующие варианты, способные преодолевать иммунитет человека, созданный за счет специфичных к вирусу антител.



Биофизика и вирусология: подходы разные, враг — общий
Медики, биологи, химики, специалисты в самых разных науках сосредоточили свои усилия на разработке противовирусных препаратов, создании вакцин и других средствах борьбы с пандемией. Выпускники и сотрудники МФТИ внесли и продолжают вносить значительный вклад в борьбу с общим врагом. // zanauku.mipt.ruВирус SARS-CoV-2 по структуре вириона относят к группе оболочечных вирусов. Такие вирусы имеют липидную мембрану, которую они «воруют» у клетки-хозяина. В этой мембране обычно находится несколько типов вирусных белков, необходимых в первую очередь для слияния вируса с клеткой-хозяином.
У SARS-CoV-2 три типа мембранных белков, один из которых является ионным каналом. «Наличие ионных каналов у вирусов — не редкость. Появился даже специальный термин – виропорины – вирусные белки, способные формировать ионные каналы», — объясняет Михаил Щелканов, заведующий лабораторией вирусологии ФНЦ Биоразнообразия ДВО РАН. «Виропорины имеются, например, у вируса иммунодефицита человека, у вирусов гриппа А и В, у коронавирусов. Ионные каналы, как правило, необходимы для изменения рН-среды либо внутри вириона как один из этапов высвобождения нуклеокапсида (как это происходит у вирусов гриппа А и В), либо внутри цистерн эндоплазматического ретикулума при сборке дочерних вирусных частиц (как это происходит у коронавирусов)».
В обоих случаях понимание особенностей работы виропоринов и механизма изменения рН среды внутри вириона крайне важно для разработки противовирусных препаратов. Исследователи проводят поиск веществ, способных блокировать вирусные ионные каналы. Это — потенциальные лекарства. Неспособность изменять рН внутри вириона должна привести к нарушению размножения вируса в организме и остановке развития инфекции.
Валентин Борщевский, заместитель заведующего лабораторией перспективных исследований мембранных белков МФТИ:
— Работа с мембранными белками, по сравнению с водорастворимыми, является весьма трудоемкой. Имея большой опыт в данной области, мы чувствовали своим долгом заняться исследованием мембранных белков SARS-CoV-2. Практически сразу после того, как стал доступен геном вируса, мы наметили потенциально интересные для нас белки SARS-CoV-2. У нас ранее были проекты по родственным вирусным белкам, так что мы имели в руках весь инструментарий. Но кроме опыта и знаний, которые, безусловно, необходимы, в науке есть место и удаче. Наши сотрудники поставили эксперимент по выращиванию кристаллов белка из SARS-CoV-2 буквально в последний день перед закрытием лаборатории на карантин. А в первый день после карантина пришли и увидели выросшие кристаллы!
«В случае вирусов мы еще очень далеки от переноса тех моделей, которые у нас есть, на реальные вирусные популяции. Дело в том, что популяция вирусов, даже в одной клетке, — это всегда, так сказать, «облако вариантов», подвижная стохастическая система с нечёткими границами. Здесь возникает интересная аналогия с физикой: реальное функционирование вирусной популяции скорее напоминает стохастичность квантовой механики. Когда я учился в МФТИ, мне казалось, что вирусологу квантовая механика никогда не пригодится в работе. Как же я ошибался! — рассказывает Михаил Щелканов.


- Fakir [22.06.2021 12:27]: Перенос сообщений в Воздействие коронавируса на организм

Гинцбург объяснил "хитрость" индийского штамма коронавируса
Индийский штамм коронавируса и его мутации опасны, так как этот вариант вируса при проникновении в клетки становится очень устойчивым к антителам, заявил РИА... РИА Новости, 22.06.2021 // ria.ruИндийский штамм коронавируса и его мутации опасны, так как этот вариант вируса при проникновении в клетки становится очень устойчивым к антителам, заявил РИА Новости директор НИЦ эпидемиологии и микробиологии имени Гамалеи Александр Гинцбург.
"Мутация индийского штамма, о которой сообщают СМИ, безусловно, опасна, так как сам индийский штамм опасен – у него другой характер взаимодействия с нашими клетками. Он не разрушает клетки, а распространяется, переходя из одной клетки в другую, образуя многоядерные клетки, тем самым, когда он уже проник внутрь, он становится очень устойчив к антителам, которые в крови циркулируют, в этом его хитрость", - сказал ученый.
Вот этого я не понял
 Как это - образует многоядерные???
Как это - образует многоядерные???Штамм коронавируса B.1.617 выявили в Индии 5 октября 2020 года в штате Махараштра, в последнее время его нашли во множестве стран. Как отмечала вице-премьер Татьяна Голикова, в России доля индийского штамма резко возрастает.

Прогресс науки есть, а прогресса человека нет? - Троицкий вариант — Наука
Вверху — статистика по Москве. Внизу — доли различных вариантов коронавируса среди отсеквенированных в России в зависимости от времени. Сиквенсов у нас мало в сравнении с другими странами, тем не менее отчетливо видно, как на наших просторах разгуливается т. н. британский штамм и т. н. индийский штамм (голубой и зеленый соответственно). Эта картинка — вежливо говоря, о том, что прогресс науки есть, а прогресса человека нет. // trv-science.ruВверху — статистика по Москве. Внизу — доли различных вариантов коронавируса среди отсеквенированных в России в зависимости от времени. Сиквенсов у нас мало в сравнении с другими странами, тем не менее отчетливо видно, как на наших просторах разгуливается т. н. британский штамм и т. н. индийский штамм (голубой и зеленый соответственно).
У нас тут походу резкая смена состава штаммов, с почти полным вытеснением "британцем" и "индусом" всех остальных. Хотя по этим данным индус не доминирует. Ну или это в среднем по России, а по Мск может и доминирует, фиг его знает.


Fakir> У нас тут походу резкая смена состава штаммов, с почти полным вытеснением "британцем" и "индусом" всех остальных. Хотя по этим данным индус не доминирует. Ну или это в среднем по России, а по Мск может и доминирует, фиг его знает.
Видимо под "многоядерными клетками" имелся в виду вирусный аналог коньюгации. Забыл как это называется. У вирусов встречается такое. Вырабатываются белки, запускающие процесс образования перемычки между клетками, как при коньюгации, и вирусные частицы передаются по этой перемычке.
А если вирус утратит способность к лизису клеток - это будет просто прекрасно.
В Москве, говорят, свой собственный штамм есть. Доминирует или нет - х. его з.
Видимо под "многоядерными клетками" имелся в виду вирусный аналог коньюгации. Забыл как это называется. У вирусов встречается такое. Вырабатываются белки, запускающие процесс образования перемычки между клетками, как при коньюгации, и вирусные частицы передаются по этой перемычке.
А если вирус утратит способность к лизису клеток - это будет просто прекрасно.
В Москве, говорят, свой собственный штамм есть. Доминирует или нет - х. его з.



«Их удалили специально»: ученый восстановил данные о геноме SARS-CoV-2
Из базы данных о геноме коронавируса пропала часть ранних записей // news.mail.ruЧасть ранних данных о геноме SARS-CoV-2 была удалена из общей базы, с которой работают ученые со всего мира, выяснил американский специалист. Ему удалось восстановить записи о генетических последовательностях ранних образцов коронавируса, полученных в Ухане — и эти образцы, как оказалось, отличаются от вариантов, распространившихся после. Сами последовательности ничего не говорят о происхождении вируса, отмечает исследователь — появился ли он естественным путем или в лаборатории. Но получается, что до сих пор, изучая происхождение вируса, ученые работали с неполным набором данных, и это могло повлиять на результаты.
Благодаря генетическим последовательностям образцов коронавируса можно выяснить, как SARS-CoV-2 перешел к людям от животных, скорее всего — летучих мышей. И последовательности, полученные на ранних этапах пандемии, наиболее ценны — они позволяют максимально приблизиться к первоначальному событию распространения вируса.
Изучая данные, опубликованные различными исследовательскими группами, доктор Джесс Блум из Онкологического центра Фреда Хатчинсона наткнулся на опубликованное в марте 2020 года исследование, в котором упоминался 241 образец SARS-CoV-2, полученный учеными из Уханя. В исследовании говорилось, что генетические последовательности образцов были загружены в онлайн-базу Sequence Read Archive, управляемую Национальной медицинской библиотекой США.
Заинтересовавшись их исчезновением, он нашел еще одну работу, в которой упоминались недостающие последовательности. Выяснив, что многие последовательности находились в облачном хранилище Google Cloud, и файлы с ними имели одинаковый формат, Блум смог восстановить 13 из пропавших записей. Подробнее свой опыт он описал в статье, опубликованной на сервисе препринтов bioRxiv.
Кажется вероятным, что последовательности удалили, чтобы скрыть их существование.
Джесс Блум
Объединив эти 13 записей с уже известными, Блум выяснил, что эти образцы старше полученных в 2019 году на рынке Уханя — в них отсутствовали мутации, характерные для той линии. Подобные последовательности попадались и раньше. Это указывает на существование другой, более ранней линии коронавируса, которая не затронула рынок.
В целом же восстановленные последовательности имели больше сходств с коронавирусом летучих мышей, чем образцы с рынка.
Возможно, наше представление о ситуации в Ухане на ранних стадиях может быть несколько некорректным.
Джесс Блум
Национальные институты здравоохранения США подтвердили, что данные были удалены в июне 2020 года по просьбе исследователя, первоначально их предоставившего. В учреждении отметили, что это стандартная практика — генетики со всего мира обмениваются информацией в подобных базах данных с самого начала пандемии и периодически вносят изменения в собственные записи.
В свете споров о происхождении SARS-CoV-2 это вызывает вопрос — не удалил ли автор записи, чтобы что-то скрыть? Однако Блум отмечает, что обнаруженные последовательности не подкрепляют ни одну из версий.
«Это исследование не дает никаких дополнительных веских доказательств для подтверждения зоонозной или лабораторной природы вируса, — говорит он. — Скорее, оно показывает, что существуют дополнительные последовательности, относящиеся к раннему периоду пандемии, о которых до сих пор не было известно. А в некоторых образцах есть мутации, которые позволяют предположить, что эти образцы эволюционно старше вируса с рынка морепродуктов в Ухане».
«Это, безусловно, большая работа, и она многое дает для понимания происхождения SARS-CoV-2», — говорит эволюционный биолог Майкл Воробей.
Другие ученые отнеслись к выводам Блума более скептически.
Если эти последовательности удалили, чтобы скрыть, то попытка провалилась. Эти данные не дают никаких новых знаний о генетическом разнообразии SARS-CoV-2 в начале пандемии. Реальность такова, что мелкие ошибки постоянно сопровождают обмен научными данными.
Роберт Гэрри, профессор иммунологии Тулейнского университета
«Язык работы необычен, в нем содержится много предположений и догадок, цитат сообщений из блогов, — добавляет специалист по микробному патогенезу Эндрю Престон из Батского университета в Великобритании. — Похоже, автор хотел указать на намеренное сокрытие китайскими властями ранних данных о последовательностях из Уханя. Однако это полностью субъективная оценка ситуации, которую будет очень трудно подтвердить или опровергнуть».
В целом же, работа подтверждает, что различные варианты коронавируса могли циркулировать в Ухане и до первых известных вспышек инфекции, связанных с рынком морепродуктов. Блум и другие ученые надеются, что исследователи, удалившие последовательности из базы, объяснят, зачем это сделали.
Конечно, это может быть просто какой-то глюк. А может быть, исследователи, секвенировавшие те геномы, обнаружили со временем какие-то косяки в своей работе, и решили убрать ошибочные или ненадёжные данные, но потихоньку, чтобы не нанести урона репутации. Нехорошо вообще-то, но - люди есть люди. Им еще гранты получать.
Но можно и в заговор поиграть. Кому это могло бы быть нужно? Ну например, если исходить из утверждения, что "восстановленные последовательности имели больше сходств с коронавирусом летучих мышей, чем образцы с рынка" - в том, чтобы убрать такие свидетельства, пожалуй, должны быть заинтересованы те, кто продвигает версию лабораторного происхождения вируса. Всё-таки это пусть небольшой, но камушек на чашу версии естественного происхождения и передачи от животных.



«Ситуация очень тяжелая» Коронавирус мутирует. Почему для россиян вакцинация — единственный способ спасения?
В России ставятся рекорды по регистрации новых случаев COVID-19. Власти опасаются, что медицинский ресурс для оказания помощи больным может быть быстро исчерпан. Почему единственный выход из этой ситуации — вакцинация, «Ленте.ру» рассказал вирусолог, доктор биологических наук Сергей Нетесов. // lenta.ruНа слуху у людей сейчас названия как минимум четырех штаммов коронавируса. От чего зависит их появление?
Говорить «штамм» — неправильно, ученые говорят «вариант». Какая разница между штаммом и вариантом? Образно выражаясь, штамм — это листочек на дереве. А вариант — это ветка с листочками. Вирус — негомогенная по последовательности нуклеотидов в геноме популяция. Вот, допустим, популяция людей большая, но люди в ней все разные. Кто-то рыжий, кто-то блондин. Один с усами, другой лысый, и так далее. С вирусами то же самое.
Новые варианты вируса отбираются в специфических условиях. Например, почти полностью расследовано появление британского варианта. Заболели несколько людей с лейкозом, у которых очень слабая иммунная система. За одним из пациентов пристально следили врачи. У него вирус циркулировал более трех месяцев. Организм человека в это время медленно образовывал антитела и другие компоненты иммунного ответа. А вирус продолжал умеренно размножаться. При этом больше шансов размножиться имели те варианты, которые могли противостоять старым антителам. У данного конкретного британского пациента это происходило несколько десятков, если не сотен раз. То есть появление британского варианта стало возможным в результате эволюционного отбора — за счет медленной иммунной реакции организма на инфицирование коронавирусом.
Судя по всему, южноафриканский вариант образовался точно так же. Тем более что в Южной Африке 15 процентов людей — ВИЧ-инфицированные, то есть с ослабленной иммунной системой.
Отслежен и калифорнийский вариант. Было два пациента-рекордсмена, у которых вирус циркулировал примерно по 150 дней. В это время происходил аналогичный отбор вариантов вируса, естественно, в сторону ухода от иммунитета.
Происхождение индийского варианта пока непонятно. Но Индия — крайне густонаселенная страна с очень тесным общением людей. И когда образовался этот индийский вариант, в стране еще практически не началось вакцинирование. Индийский вариант многогранен. Назвали его так по стране, где впервые зарегистрировали. Но сейчас уже ВОЗ по этическим причинам предложила не привязывать варианты вирусов к странам, а дать им нейтральные имена — по буквам греческого алфавита. Альфа — британский вариант, бета — южноафриканский вариант, гамма — бразильский, дельта — индийский. Сейчас их уже больше выявлено, так что еще несколько букв греческого алфавита занято.
И поскольку вариант — это не один листочек, а целая ветвь, то на ней происходят все новые и новые мутации. Так возник вариант дельта-плюс.
В чем заключается его специфичность? Он способен лучше уклоняться от вакцин?
Вариант дельта-плюс сумели идентифицировать по изменениям в геноме, но пока не выяснили, обладает ли он какими-то новыми свойствами по эффективности распространения, скорости размножения, ухода от иммунитета и так далее. Но за ним следят. По предварительным оценкам, он мало отличается от штаммов основной ветки варианта дельта. И отличия в геноме не обязательно означают отличия по свойствам.
В Израиле привились почти 70 процентов населения, Великобритания приближается к 70 процентам, Соединенные Штаты вакцинировали уже более 50 процентов жителей. В этих странах, вернее всего, уже не будет такого эволюционного отбора вируса, так как поле для его распространения стремительно уменьшается.
А мы в России — чудаки. Имея несколько вакцин, вакцинировали чуть более десяти процентов населения. Единственный выход — как можно быстрее всем вакцинироваться. Надо преграждать путь вирусу. Сейчас барьер, который мы сделали для вируса, очень низкий. А надо, чтобы он был высокий. Это означает, что процент вакцинированных у нас должен быть железно больше 70.
Сейчас у нас все шансы получить какие-нибудь чисто российские варианты SARS-CoV-2. А мы знаем, что у нас в стране многие явления с острыми углами. Если что-нибудь существенное отберется, то это будет очень сурово.



«Он начинает адаптироваться к вакцинам» Ученые нашли новый «мю»-штамм коронавируса. Насколько он опасен для России?
В мире заговорили о новом штамме коронавируса «мю» — он якобы способен уклоняться от антител, которые сформировались в результате вакцинации или инфицирования коронавирусом. «Лента.ру» поговорила с иммунологом Николаем Крючковым о том, насколько опасен колумбийский штамм коронавируса для России и как с ним бороться. // lenta.ruДо недавнего времени наиболее заразным и смертоносным штаммом коронавируса считалась «дельта». Российские ученые были уверены, что возникновение и распространение нового штамма, который окажется тяжелее «дельты», маловероятно. Однако теперь появился новый штамм коронавируса — «мю». По данным исследователей из США, он способен уклоняться от антител, сформированных как в результате вакцинации, так и после победы организма над реальной болезнью. «Лента.ру» поговорила с иммунологом Николаем Крючковым о том, насколько опасен колумбийский штамм коронавируса для России, почему он адаптировался к вакцинам и как остановить мутацию SARS-CoV-2.
***
«Лента.ру»: Как появился «мю»-штамм коронавируса и где он сейчас циркулирует?
Николай Крючков: Фактически первые случаи инфицирования штаммом «мю» зафиксированы в январе этого года в Колумбии. С тех пор происходило распространение этой линии, однако темпы распространения были значительно ниже, чем, например, у той же «дельта»-линии. В 40 странах мира, если я правильно помню, такие случаи инфицирования зафиксированы. Особые регионы распространения — некоторые страны Южной Америки, например, Колумбия и Эквадор, также это Франция, Испания и США. В Великобритании эта линия циркулирует, но в значительно меньшем количестве.
...
То есть, получается, новый штамм возник из-за вакцинации?
Это обычное дело, когда идет массовая вакцинация. Наиболее критическая история — когда мы подбираемся к порогу коллективного иммунитета. Не обязательно прямо близко к нему, но когда доля вакцинированных уже становится заметной — 30-40 процентов населения. В этом случае происходит направленный отбор штаммов инфекции для того, чтобы приобрести дополнительную защиту и устойчивость к вакцинации.
Почему это происходит? Так происходит отбор. Поскольку вакцинация становится значимым популяционным фактором, инфекция его замечает и начинает адаптироваться — выживают более устойчивые к возникшему в ответ на вакцинацию иммунитету штаммы. Поэтому в тех местах, где очень высокая плотность населения и относительно высокий процент вакцинированных — при этом я не говорю, что это обязательно уровень коллективного иммунитета, речь идет об уровне 20-60 процентов, — вирус начинает адаптироваться, начинают отбираться более устойчивые варианты.
Но это пока не значит, что они совершенно устойчивы и на них вакцинация никак не действует. По сравнению с ранними «послеуханьскими» вариантами, до появления «альфа», «бета» и «гаммы», у них была одна степень защиты к вакцинам — потому что вакцинации еще не было. Она только к концу появилась. А потом, на последующей линии, это стало сильно влиять на формирование. Это естественный, не удивительный процесс
...
Когда этот новый штамм придет в Россию?
Я думаю, что он уже пришел в нашу страну. Надо понимать, как мы его обнаруживаем. Мы определенное количество образцов вируса секвенируем (устанавливаем — прим. «Ленты.ру»), часть из ежедневных случаев мы отбираем для этого. Проблема в том, что «дельта» и «дельта плюс» быстро захватили Россию. Это очень мощные линии — они сожрали в восточном полушарии фактически все остальные линии, остался только «дельта плюс» — он сам по себе сильный, и чтобы его победить, нужно обладать еще лучшими характеристиками. Не факт, что «мю» обладает этими характеристиками, потому что все-таки он распространился в Южной Америке и в процентном отношении заметно уступает «дельте», «дельте плюс» и «гамме».
В России он есть наверняка. Думаю, пока это небольшой процент. Но мы не знаем точно, потому что интенсивность полногеномного секвенирования, то есть количество образцов, которое ежедневно секвенируется, в России очень маленькое. Оно ни в какое сравнение с британским не идет — на порядки разница. И поэтому очень высок шанс не заметить их, пока они не наберут силы.
Но наберет ли силу «мю» — вопрос, потому что в данном случае он пришел на поляну, которая уже занята очень сильным игроком. Чтобы начать откусывать кусок от этой популяции, нужно быть еще сильнее.
Та работа, которую я видел по лабораторной оценке ослабления специфического иммунитета, показывает, что ослабевание действительно происходит. Но, во-первых, оно сопоставимо с «дельтой», «дельтой плюс» и «лямбдой». Во-вторых, безусловно, по сравнению с предшествующими линиями оно заметно, но оно не настолько кардинально. То есть оно не делает вакцину бесполезной, а просто снижает ее эффективность.
И что с этим делать? Как продолжать бороться с вирусом, если он постоянно мутирует и подстраивается под вакцины?
Снижение эффективности вакцин будет происходить, но я рассчитываю, что оно будет не лавинообразным, а постепенным и поэтапным. Это дает возможность за тот период, пока оно происходит, скорректировать схему применения вакцин. Но речь идет не просто о знаменитой бустерной дозе — то есть ревакцинации. В данном случае я имею в виду бустерную дозу, например, в виде сразу двух инъекций, а через три-четыре недели — третьей. То есть вместо двух инъекций — три.
Следующее — мы можем увеличить интервал между инъекциями. Вместо 21 дня делать перерыв в 28 или 35 дней. Это тоже работает. Самое оптимальное — постепенно менять антигенный состав вакцин. После этого начать массовую вакцинацию уже новым препаратом. То есть не прививать отдельно старым и отдельно новым, а заменить старый препарат на новый. Это даст возможность вернуть эффективность вакцин в изначальные 90-95 процентов.
Ни один новый штамм, который появился, не аннулирует и не обнуляет защиту, которую дает вакцина, но он ее снижает. Не кардинальным образом, но заметно снижает. Вакцины, не адаптированные к новым штаммам, все равно продолжают работать.



Мутации COVID-19 направлены на быстрое заражение людей по воздуху
Коронавирус мутирует, чтобы быстро и эффективно заражать людей по воздуху. Это показало исследование Национального института аллергии и инфекционных заболеваний США, пишет 1 октября The New York Times. // iz.ru«Дельта», появившийся впервые в Индии, является самым опасным штаммом. У него самый короткий инкубационный период. Об этом 1 октября рассказал гендиректор компании «Клиникал Экселанс Груп», кандидат медицинских наук, иммунолог Николай Крючков.


Copyright © Balancer 1997..2023
Создано 08.04.2020
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
Создано 08.04.2020
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.

 инфо
инфо инструменты
инструменты Naib
Naib
 haleev
haleev

 Fakir
Fakir





 Bredonosec
Bredonosec



 Fakir
Fakir

